
稳定细胞株是指通过基因工程手段,将外源基因(或经过编辑的基因)整合到宿主细胞基因组中,并能长期稳定遗传和表达的细胞系。它是生命科学研究、药物筛选和生物制品(如抗体、重组蛋白)生产中的核心工具。
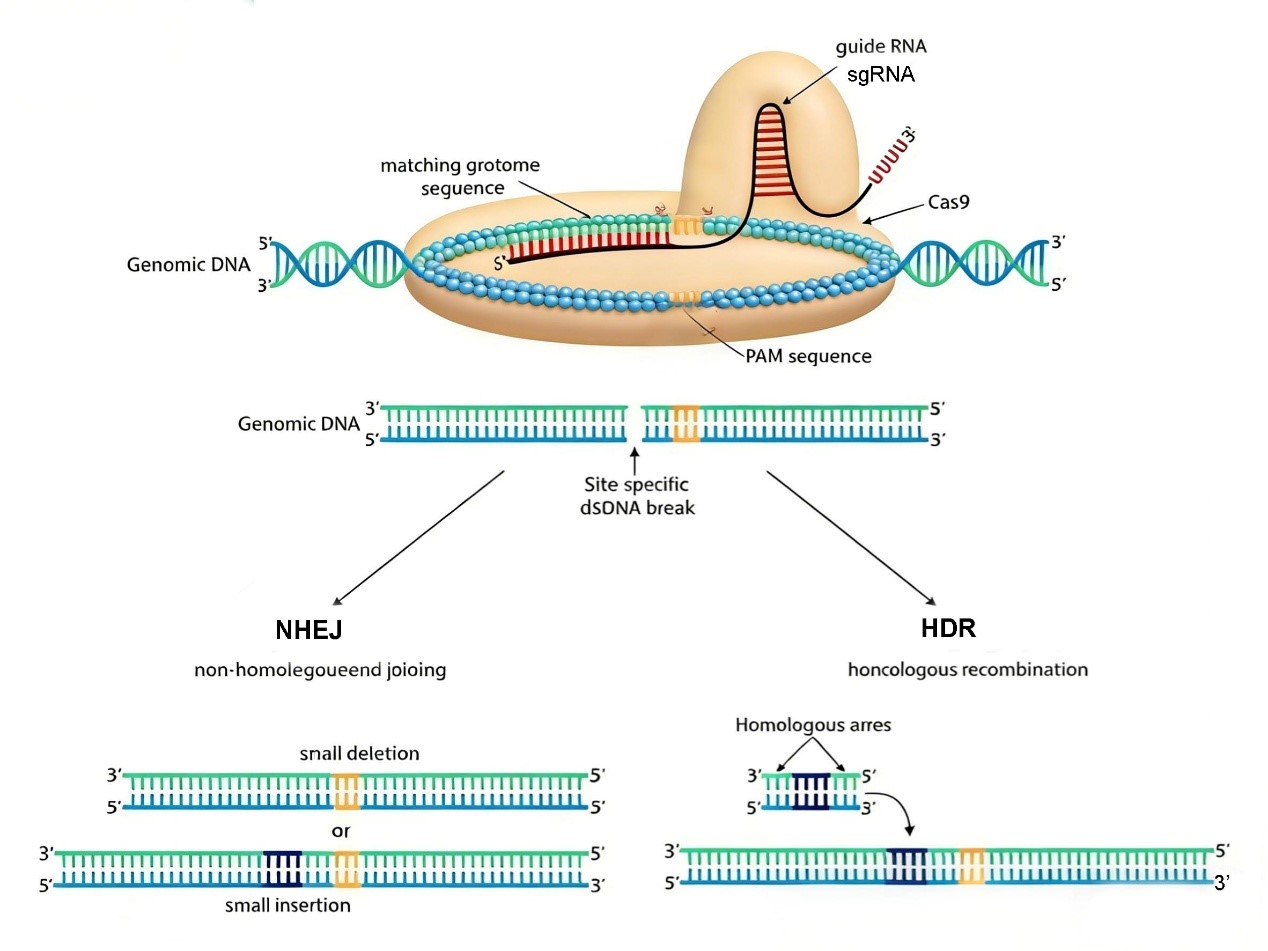
CRISPR-Cas9 是源于细菌免疫系统的革命性基因编辑工具,该系统的核心在于SgRNA引导Cas9蛋白对特定基因序列进行精准识别和切割,CRISPR-Cas9 基因编辑常用于细胞株基因编辑中。CRISPR-Cas9基因敲除系统通过Cas9内切酶切割双链DNA后,生物体主要启动NHEJ修复途径(非同源末端连接)。NHEJ修复机制是一种错误倾向的修复方式。在DNA发生双链断裂时,该修复途径被激活,在DNA断裂处随机插入或缺失几个碱基,然后将切割未端连接起来。这一过程极容易导致切割位点发生移码突变,从而破坏基因的开放阅读框,导致无意义介导的mRNA降解,最终实现基因沉默。
对于基因的敲除,sgRNA分为两个部分-5'端的靶标互补区(与靶 DNA配对)和3'端的scaffold 区(结合 Cas9 蛋白),&RNA靶向基因的N端区域,以确保最大程度地破坏基因功能。
设计并构建载体
根据实验目的设计sgRNA。
将sgRNA表达框以及筛选标记基因(如抗药性基因 puromycin、neomycin,或荧光蛋白基因 GFP)克隆到CAS9载体中。
将载体导入细胞
方法:电转、慢病毒/逆转录病毒感染(效率高,尤其适用于难转染细胞)。
将重组DNA或病毒导入目标细胞。
施加筛选压力
在转染/感染后,在培养基中加入相应抗生素(如嘌呤霉素)或通过流式细胞术分选荧光阳性细胞。
此步骤淘汰未成功导入外源基因的细胞,留下初步的“混合细胞群”。
单克隆化与扩增
将混合细胞群高度稀释,接种到96孔板中,确保理论上每孔只有一个细胞生长,形成单克隆。
等待并观察单克隆形成,再将其逐步扩增至细胞系规模。
鉴定与验证
基因组水平:PCR、测序验证靶基因的编辑是否成功。
蛋白水平:Western Blot、免疫荧光检测目标蛋白表达或缺失情况。
功能验证:根据研究目的进行表型或功能实验。
服务类型 | 客户提供 | 服务内容 | 周期 | 价格 |
敲除稳定细胞株构建 | ² 目的基因信息 ² 实验细胞信息 | ² 细胞转染预实验:含细胞转染、抗性筛选浓度测试、单克隆生长测试。 ² gRNA序列设计、Cas9-gRNA载体构建. ² 稳定细胞株筛选:质粒通过电转转入细胞、多克隆细胞株筛选。 ² 单克隆细胞株筛选:单克隆细胞株经有限稀释法筛选后扩大培养 ² 验证:PCR和测序敲除效率验证、酶切验证 ² 出具实验报告 | 40-50工作日 |
高精度:sgRNA可设计为约20个碱基,理论上能在全基因组中精确定位。
高效率:在多数细胞类型中切割效率显著。
强灵活性:可编辑几乎任何基因,适用于基因功能研究、基因治疗、农作物改良等领域。
低成本与简便性:相较于ZFN、TALEN等早期技术,CRISPR-Cas9的设计与制备更简单、成本更低。